

2024年10月10日,温州医科大学李校堃院士团队黄志锋/宋林涛课题组,在国际代谢领域顶级学术期刊Cell Metabolism(IF=27.7)在线发表题为“Hepatic FXR-FGF4 is required for bile acid homeostasis via a FGFR4-LRH-1 signal node under cholestatic stress”的重要成果。
该研究鉴定了肝脏中的FGF4作为FXR的直接靶基因,通过旁分泌信号下调胆汁酸关键合成酶CYP7A1和CYP8B1。这一以肝脏为中心的通路充当了肝内胆汁酸含量的一线检查点(checkpoint),与肠道分泌的FGF15/19共同构成肝肠调控环路,精确调节胆汁酸稳态,以抵御胆汁淤积及其引发的肝损伤。相关工作是对过去二十年FXR-FGF信号轴调控胆汁酸理论的有力补充,为胆汁淤积及相关疾病的治疗提供了新思路和新策略。这是黄志锋课题组继去年发现FGF4单次中枢给药可产生长达7周以上持久控糖效应(Cell Metabolism, 2023, 35(6):1022-1037)后的又一重要科学发现。

胆汁酸对于脂溶性营养物的消化和吸收至关重要,同时也作为信号分子调节机体代谢和能量稳态。胆汁酸稳态或相关信号途径的紊乱会引起胆汁淤积、肝损伤和代谢紊乱,严重者可诱发肝癌。胆汁酸稳态的维持主要通过负反馈机制和时空控制的肠肝循环。胆汁酸合成的调节主要依赖于肝脏和肠道中法尼醇X受体(FXR)的激活,它感知胆汁酸水平并控制胆汁酸合成、转化、运输和信号相关的基因转录。
之前的研究表明,在餐后肠内胆汁酸增加的情况下,激活的FXR可促进肝脏中SHP、MAFG以及回肠中成纤维细胞生长因子15/19 (FGF15/19)的转录。肠道分泌的FGF15/19选择性地结合并激活肝成纤维细胞生长因子受体4(FGFR4)-β-klotho(KLB)复合体,并以尚未解析的信号路径抑制胆汁酸关键合成酶基因Cyp7a1和Cyp8b1的转录。这种内分泌途径与食物消化的生理反应相结合,在餐后阻止新的胆汁酸合成,是防止过量胆汁酸对肝脏和肠道系统潜在毒性的必要生理需求。由于回肠与肝脏分离,而肝脏是胆汁酸合成的主要器官,因此,回肠FGF15/19通路的功能滞后于肝脏在早期餐后胆汁酸合成中的作用。这种时空限制提出了一个关键问题:当内分泌FGF15/19信号通路尚未发挥作用时,肝内胆汁酸合成以及总胆汁酸含量是如何在肝脏中受到控制的?
为了回答这一问题,课题组构建了内分泌FGF15功能缺失的基因敲除小鼠。结果表明,在缺乏FGF15的情况下,激活FXR后仍然可以维持对Cyp8b1表达的抑制,但无法抑制Cyp7a1。有趣的是,这种抑制作用在对应受体FGFR4缺乏的小鼠肝脏中完全丧失。因此,研究团队提出一个重要假设,即在肝脏中存在另一个由FXR控制的FGF家族成员,以自分泌或旁分泌途径直接激活肝脏FGFR4来抑制胆汁酸合成,特别是通过抑制Cyp8b1路径。
为验证该假设,研究团队通过系统性筛选分析导致FXR作用差异的FGF家族成员,发现肝脏FGF4是FXR的另一个直接靶基因。FGF4作为肝FXR的信号介质,可以抑制Cyp7a1和Cyp8b1的转录,其中对Cyp8b1的抑制作用更为明显,进而抑制肝脏胆汁酸合成,改善胆汁淤积症。进一步机制研究发现,FXR-FGF4的这种以肝脏为中心的作用是通过一个从未被报道的FGFR4-LRH-1信号传递途径介导的:当 FGF4 激活 FGFR4 后,细胞质中的核受体LRH-1 被招募到 FGFR4 激酶区域,导致通过磷酸化介导的 LRH-1 失活并失去对 Cyp7a1 和 Cyp8b1 基因启动子的靶向作用。重要的是,研究团队于小鼠中发现的现象在临床患者中得到了充分验证,相比健康人群,胆汁淤积患者肝脏FXR和FGF4表达水平显著减少、相关信号轴明显受损。
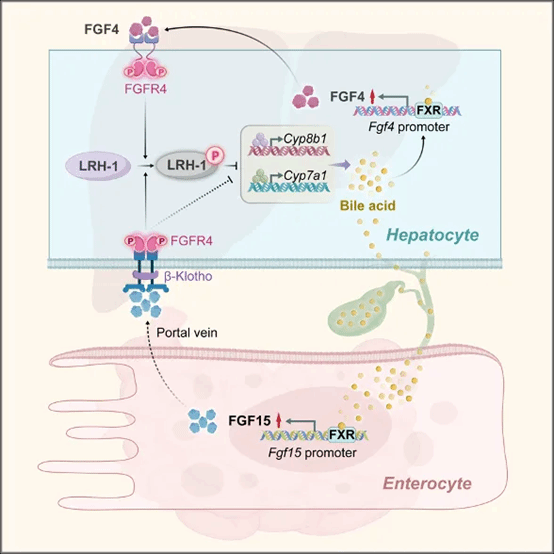
图1. FXR-FGF4-FGFR4-LRH-1信号通路调控胆汁酸合成的机制模式图。
综上所述,本研究鉴定了肝脏FGF4作为FXR的直接转录靶基因,也是外周FGF15/19通路上游以肝脏为中心的胆汁酸合成反馈抑制因子。胆汁酸合成的精确时空控制对于在响应多种生理需求和病理挑战时维持胆汁酸稳态至关重要。这一肝脏FXR-FGF4到FGFR4-LRH-1通路的阐明,明确并拓展了精确时空调控的机制和模式。相关发现为肝脏胆汁酸合成和肠肝或全身胆汁酸稳态调控提供了新的机制见解,也为设计胆汁淤积和相关疾病的治疗新策略开启了一扇新的大门。
温州医科大学黄志锋教授、李校堃院士和宋林涛博士为论文共同通讯作者;宋林涛以及课题组博士后侯煜姝和硕士研究生徐达为论文共同第一作者。相关工作得到了国家自然科学基金重大研究计划集成项目、浙江省自然科学基金重大项目以及瓯江实验室拔尖人才计划等的支持。
本研究工作也受到了两位相关领域知名专家的点评:
贾伟平(中国工程院院士,上海交通大学讲席教授)
胆汁酸是一类由胆固醇在肝脏中合成的类固醇物质,它们在消化系统中起着至关重要的作用,不仅促进脂质和脂溶性维生素的吸收,还作为信号分子参与了糖脂代谢、能量平衡和免疫调节等生理过程的调控。胆汁酸的稳态对于肝脏健康至关重要,其代谢紊乱与多种肝病的发生发展有关,包括非酒精性脂肪肝病(NAFLD)、原发性胆汁性胆管炎(PBC)等。
温州医科大学李校堃院士和黄志锋教授团队深入研究了胆汁酸稳态这一复杂的生理过程,发现肝脏 FGF4作为FXR的直接靶基因,通过FGFR4-LRH-1信号通路在胆汁酸合成中发挥着关键调控作用。这一发现不仅填补了非餐后或肝内胆汁淤积情况下胆汁酸稳态调节机制的研究空白,还揭示了肝脏内部的精细调控网络,为理解胆汁酸调控的分子机制提供了新视角。此外,该研究丰富了我们对FGF信号网络的认识,为基于FGF的结构改造和药物设计提供了新的思路。有关非促分裂型FGF4变构体的实验验证为开发胆汁淤积性肝病的新型治疗策略提供了重要科学依据。
姜长涛(北京大学教授,科学探索奖获得者)
胆汁酸作为一类重要的内源性信号分子,其在人体内的稳态调节对于维持肝脏健康、调控糖脂代谢以及能量平衡等方面起着至关重要的作用。近年来,随着胆汁酸信号研究的深入,FXR、TGR5等受体在胆汁酸稳态中的作用逐渐被揭示,基于这些靶点的药物研发也取得了一定的进展。然而,胆汁酸稳态的复杂性意味着我们对其调控网络的理解仍然有限。多项研究证实,胆汁酸激活肠道FXR,通过肠道FGF15/19内分泌途径响应餐后或异常的肠内胆汁酸含量变化,启动负反馈调控通路,维持机体胆汁酸稳态。然而,在非餐后状态或者肝内胆汁淤积情况下,对于调控肝脏内部胆汁酸合成,肝脏FXR所涉及的信号介质鲜为人知。
本文通过系统性筛选分析导致FXR作用差异的FGF家族成员,鉴定出肝脏FGF4是FXR的直接靶基因,它通过肝脏细胞内FGFR4-LRH-1信号节点,转录控制Cyp7a1和Cyp8b1的表达。肝脏FXR-FGF4通路主要用于控制胆汁酸的合成和肝内胆汁酸总量的平衡,减轻肝内胆汁淤积和进一步的肝脏损伤。这种旁分泌途径独立于或协同内分泌 FGF15 介导的抑制途径共同作用,从而精确、动态地调节胆汁酸水平,防止胆汁淤积及其相关损伤。这种对生理过程的深入研究,有助于理解机体如何在不同状态下维持胆汁酸稳态;而FGF4变构体在多种胆汁淤积症模型中显示出的改善效果,为研发治疗代谢性肝病的FGF类药物提供了理论基础。这项工作也为FGF家族在代谢调控中的其他潜在作用提供了新的研究思路,可能揭示更多关于代谢途径交叉调控的重要信息。

