

6月7日,温州医科大学李校堃/陈高帜/穆萨·穆罕默迪团队在国际顶级学术期刊Nature在线发表重要成果:“Structural Basis for FGF hormone Signaling”,该论文揭示了Klotho蛋白和硫酸乙酰肝素(Heparan sulfate, HS)作为共受体协同介导内分泌FGF结合FGFR形成不对称1:2 FGF–FGFR二聚体从而激活下游信号通路的分子机制。在国际上首次完整展示了FGF23、FGFR 、Klotho和HS四元复合物分子机器组装和信号激活模式,为糖尿病,慢性肾病等代谢性疾病的药物研发提供了重要的结构信息。这是该团队继2018年在Nature报道内分泌FGF-FGFR-Klotho三元复合物互作特征之后的又一延续性重大发现,完成了FGF信号激活胞外区域的“最后一张拼图”。

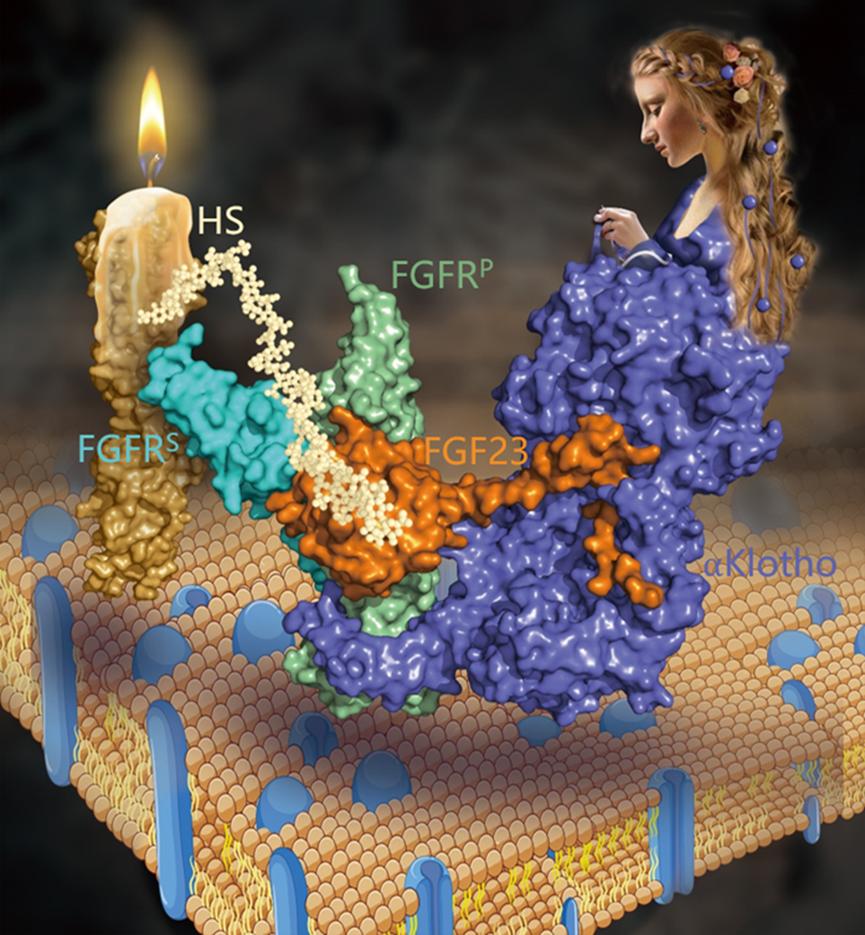
团队相关负责人用烛光里的纺织女神作类比介绍该模型:Klotho女神(希腊神话中命运三女神之一的纺织女神,负责纺织生命长度)在夜晚纺织,FGF就像是纺织所用的线,而两个FGFR就像是她手中的两根纺针,HS就像是夜中燃烧的烛光,照亮黑暗,协助Klotho女神更好的传递生命信号。
人成纤维细胞生长因子(fibroblast growth factor, FGF)家族由18个包含β-trefoil同源结构域的多肽构成,分为5个旁分泌亚家族和1个内分泌亚家族。旁分泌亚家族调控胚胎发育过程中的多个重要事件,而内分泌亚家族成员(FGF19、FGF21和FGF23)是机体调节胆汁酸、脂质、葡萄糖、维生素D和矿物质离子稳态的重要激素,也是治疗一系列代谢性疾病的重要靶点,包括2型糖尿病、肥胖、非酒精性脂肪性肝炎(NASH)、原发性胆汁性肝硬化、胆汁酸腹泻、肾磷酸盐消耗性疾病和慢性肾脏疾病(CKD)等。
FGF通过结合并二聚化单次跨膜型FGF受体酪氨酸激酶(FGFR1-3的b和c亚型以及FGFR4)进而发挥其生命活动调控功能。其中,旁分泌FGFs依赖硫酸乙酰肝素(HS)糖胺聚糖作为必需共受体来稳定地结合和二聚化其同源FGFR。细胞外FGFR二聚化促进细胞内激酶结构域的热力学弱不对称复合物的形成,该复合物介导A-环酪氨酸的磷酸化,从而激活FGFR激酶及其细胞内信号传导。另一方面,内分泌FGF结构的差异导致其对HS以及FGFR的结合能力被显著削弱,使得单HS不足以促使内分泌FGF结合并诱导FGFR受体二聚化。为了弥补这一不足,内分泌FGF家族进化出了对αKlotho(结合FGF23)或βKlotho(结合FGF19和FGF21)蛋白的结合能力使得Klotho蛋白成为内分泌FGF信号传导的共受体。2018年,αKlotho在FGF23相关信号传导中的共受体作用机制被成功解读,即αKlotho通过其KL2结构域中的长α1β1环(称为受体结合手臂,RBA)以及KL1和KL2结构域交界处的大裂缝分别结合FGFR1c和FGF23,促使FGF23与其同源FGFR相互结合并维持该复合物的稳定性(李校堃/陈高帜/穆萨·穆罕默迪团队2018年发表于Nature)。然而,HS作为内分泌FGF的另一个必需的共受体,其共受体作用机制始终未知,依然限制着内分泌FGF相关药物的研发。
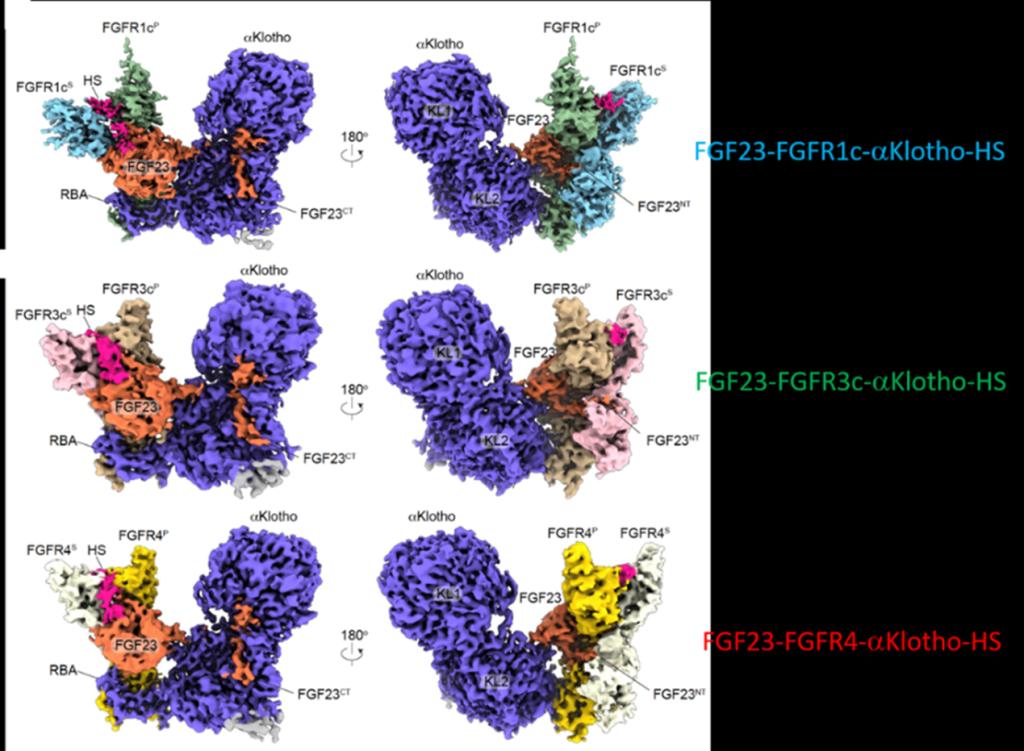
图示为三个FGF23-FGFR-αKlotho-HS四元复合物单颗粒冷冻电镜结构
为此,研究团队解析了三个双重共受体协同作用下形成的FGF23-FGFR四元复合物(FGF23-FGFR1c-αKlotho-HS,FGF23-FGFR3c-αKlotho-HS,FGF23-FGFR4-αKlotho-HS)的冷冻电镜结构。三个结构都显示出相同的不对称1:2:1:1 FGF23–FGFR–Klotho-HS四元复合物,HS使1:1:1的FGF23-FGFR–Klotho三元复合物能够募集一个单独的FGFR(第二个FGFR)从而诱导受体不对称二聚化激活。同时,基于细胞层面的验证发现,本研究所提出的受体二聚化激活不对称模型可推广到旁分泌FGF,这一发现有别于传统的FGFR二聚化激活的对称模型。在传统认知中,旁分泌FGF一直被认为是通过两个FGF,两个FGFR及肝素分子以2:2的对称模式相互结合形成功能性二聚体从而激活下游信号通路调控发育,分化,增殖,再生等生命过程,而本研究提出的FGFR非对称激活模型丰富了FGF调控信号的理论认知,拓展了FGF领域的认知边界,为FGF药物尤其是代谢性疾病药物的精准设计提供了全新的研究范式。
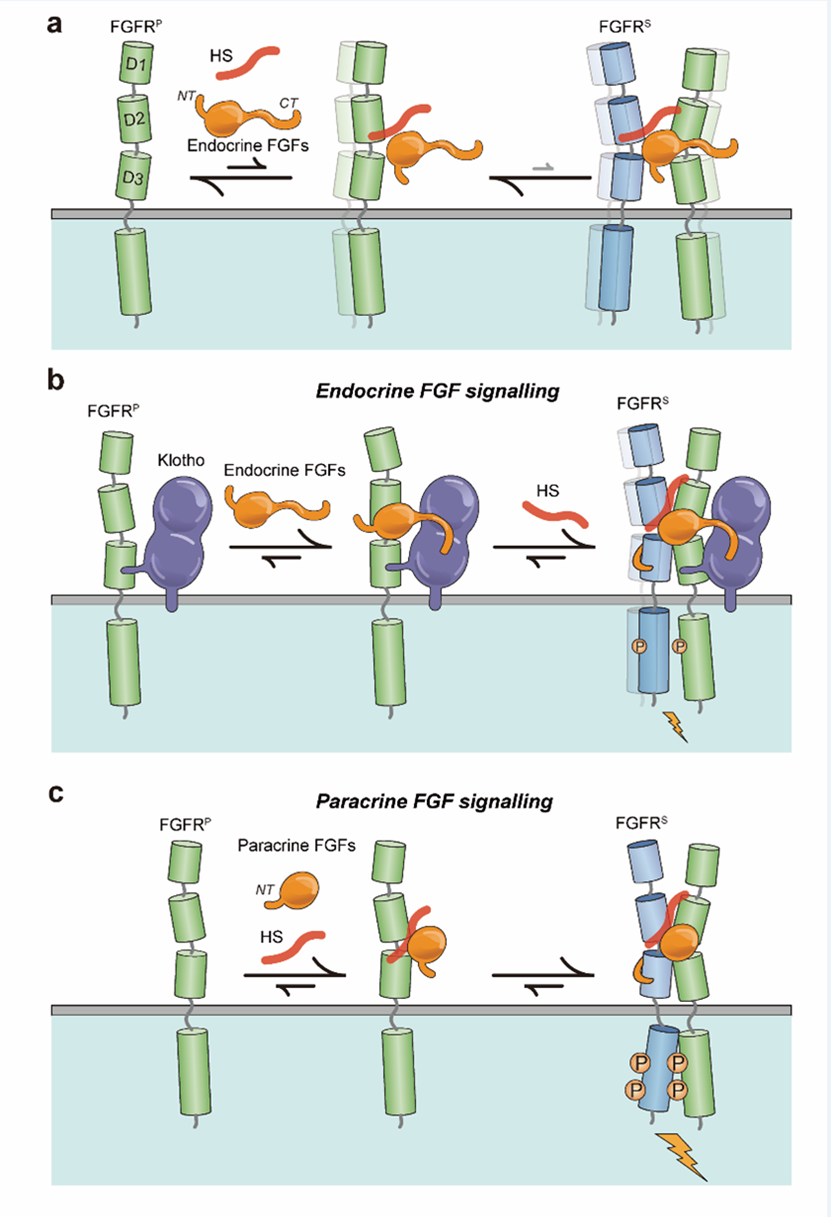
不对称受体二聚化是FGF信号传导的普遍机制
此外,结构显示,FGFR与FGFR之间以及FGF23与第二个FGFR之间的相互结合区域在三个不同的FGFR之间保持高度保守,这提示不同的FGFR之间可能可以通过这种不对称的二聚化模型形成异源二聚体。为验证这一猜想,作者构建了分别缺失部分FGF23结合能力的FGFR4及FGFR1c受体,这两个突变的受体单独均无法实现二聚化激活,而当将他们共同表达于同一个细胞中时,两者可以形成异源二聚体FGF23-FGFR4-FGFR1c-αKlotho,从而激活下游信号。这是首次报道FGFR的异源二聚化,为实现定性甚至定量精确微调FGF信号传导提供了新机制和新思路。
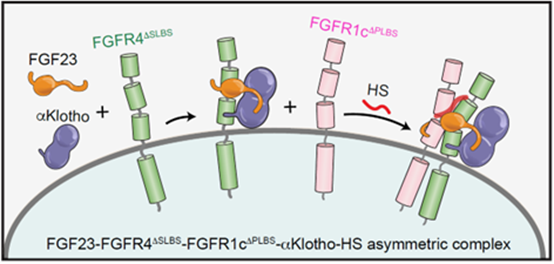
图示为FGF23和αKlotho与FGFR4突变体形成三元复合物后在HS的辅助下募集FGFR1c突变体形成不对称异源二聚体的示意图
温州医科大学药学院李校堃院士,陈高帜教授和穆萨·穆罕默迪教授为论文共同通讯作者;陈凌峰博士,博士生付丽丽、孙京川博士、硕士生黄志强和方明真为论文共同第一作者;硕士生刘昕、卢俊良、潘子祥为署名作者;温州医科大学是本论文的第一作者及第一通讯单位;相关工作得到了国家科技部重点研发计划、国家自然科学基金、浙江省杰出青年基金、浙江省鲲鹏行动计划等的支持。

